Un enlace químico es la unión de dos átomos de un compuesto químico, debida a la existencia de fuerzas de atracción entre ellos.
ENLACE IÓNICO
Se da en la unión de átomos que tiendan a ceder electrones con facilidad (metales), con otros que tiendan a cogerlos fácilmente (no metales). Los elementos que generalmente lo forman tienden a estar muy separados en la tabla periódica (diferencia grande de electronegatividades).
Ejemplo: Na (11 e-) + Cl (17 e-) = NaCl (Cloruro de sodio), los 7 electrones del tercer nivel de energía son cedidos del cloro al sodio para que ambos átomos tengan su segundo nivel completado.
Es evidente que en este caso se encuentran dos átomos ideales, uno tiende a ceder electrones y el otro a tomarlos.
Los compuestos con enlaces iónicos tienen en común estas propiedades:
1. No se forman moléculas aisladas, sino redes cristalinas, muy fuertes y estables. Para separar los iones de la red se requiere bastante energía.
Esto explica que los compuestos iónicos sean:
- sólidos no conductores.
- de elevado punto de fusión.
- duros y quebradizos (como consecuencia de la estructura de la red).
2. Los iones pueden ser separados de la red fundiendo el compuesto o bien disolviéndolo en sustancias polares (se explicará más adelante este concepto) como el agua, logrando la separación de los iones de la red. Por este motivo estos compuestos en disolución acuosa conducen la corriente eléctrica.
ENLACE COVALENTE
El enlace covalente, se dará entonces entre átomos de similar electronegatividad, compartiendo pares de electrones (aportando al par un electrón cada átomo), en número suficiente para que cada átomo posea después de establecido el enlace de 8 electrones en la última capa.
Ejemplo: CH4, gas metano, en el que los 4 electrones de valencia del Carbono – los que tiene por últimos en su segundo nivel de energía, los comparte con el único electrón de cada uno de los 4 átomos de Hidrógeno (se completan 8 electrones en el segundo nivel del C y 2 electrones en el primero del H).
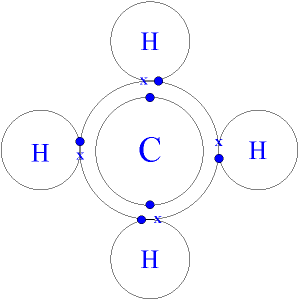
Cuando el enlace lo forman dos átomos del mismo elemento, la diferencia de electronegatividad es cero, entonces se forma un enlace covalente no polar. El enlace covalente no polar se presenta entre átomos del mismo elemento o entre átomos con muy poca diferencia de electronegatividad. Un ejemplo es la molécula de hidrógeno, la cual está formada por dos átomos del mismo elemento, por lo que su diferencia es cero. Otro ejemplo, pero con átomos diferentes, es el metano. La electronegatividad del carbono es 2.5 y la del hidrógeno es 2.1; la diferencia entre ellos es de 0.4 (menor de 0.5), por lo que el enlace se considera no polar. Además el metano es una molécula muy simétrica, por lo que las pequeñas diferencias de electronegatividad en sus cuatro enlaces se anulan entre sí.
Un enlace covalente en el que los electrones se comparten desigualmente se denomina enlace covalente polar. El término polar significa que hay separación de cargas. Un lado del enlace covalente es más negativo que el otro. Para ilustrar una molécula que tiene un enlace covalente polar, consideremos la molécula de ácido clorhídrico.
H (1 e-) y Cl (7 e- de valencia). Sin embargo, puesto que la electronegatividad del Cl (3.0) es mayor que la electronegatividad del H (2.2), el átomo de Cl atrae con mayor fuerza el par de electrones compartidos que el átomo de H.
ENLACE METÁLICO.
Los átomos de los elementos metálicos tienden a tener pocos electrones de valencia (electrones de la última capa). No pueden formar enlaces covalentes, pues compartiendo electrones no pueden llegar a adquirir la estructura de gas noble.
La estabilidad la consiguen de otro modo, los electrones de valencia de cada átomo entran a formar parte de "un fondo común", constituyendo una nube electrónica que rodea a todo el conjunto de iones positivos, dispuestos ordenadamente, formando un cristal metálico.
Las propiedades de estos enlaces son:
-Alta conductividad térmica y eléctrica, los electrones pueden moverse con libertad por la nube electrónica.
-Son dúctiles (factibles de hilar) y maleables (factibles de hacer láminas), su deformación no implica una rotura de enlaces ni una aproximación de iones de igual carga, como ocurría en los compuestos iónicos por ejemplo.
-Los puntos de fusión son moderadamente altos, la estabilidad de la red positiva circundada por la nube de electrones es alta.
-Son difícilmente solubles en cualquier disolvente, por el mismo motivo que justifica el punto anterior. (Pensar en la forma de "atacar" el agua a un compuesto iónico, en un metal que es "un todo uniforme" no existe esa posibilidad.)
Estructura de Lewis.
Representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importante para predecir estabilidades relativas.
Pasos para representar un enlace con esa estructura: Se escoge el átomo central (nunca hidrógeno), se cuentan los electrones de valencia, se forman enlaces con rayas entre el átomo del centro y los periféricos y los restantes se colocan como pares solitarios alrededor.
La estructura de Lewis permite ilustrar de manera sencilla los enlaces químicos, en ella, el símbolo del elemento está rodeado de puntos o pequeñas cruces que corresponden al número de electrones presentes en la capa de valencia.
BIBLIOGRAFÍA




